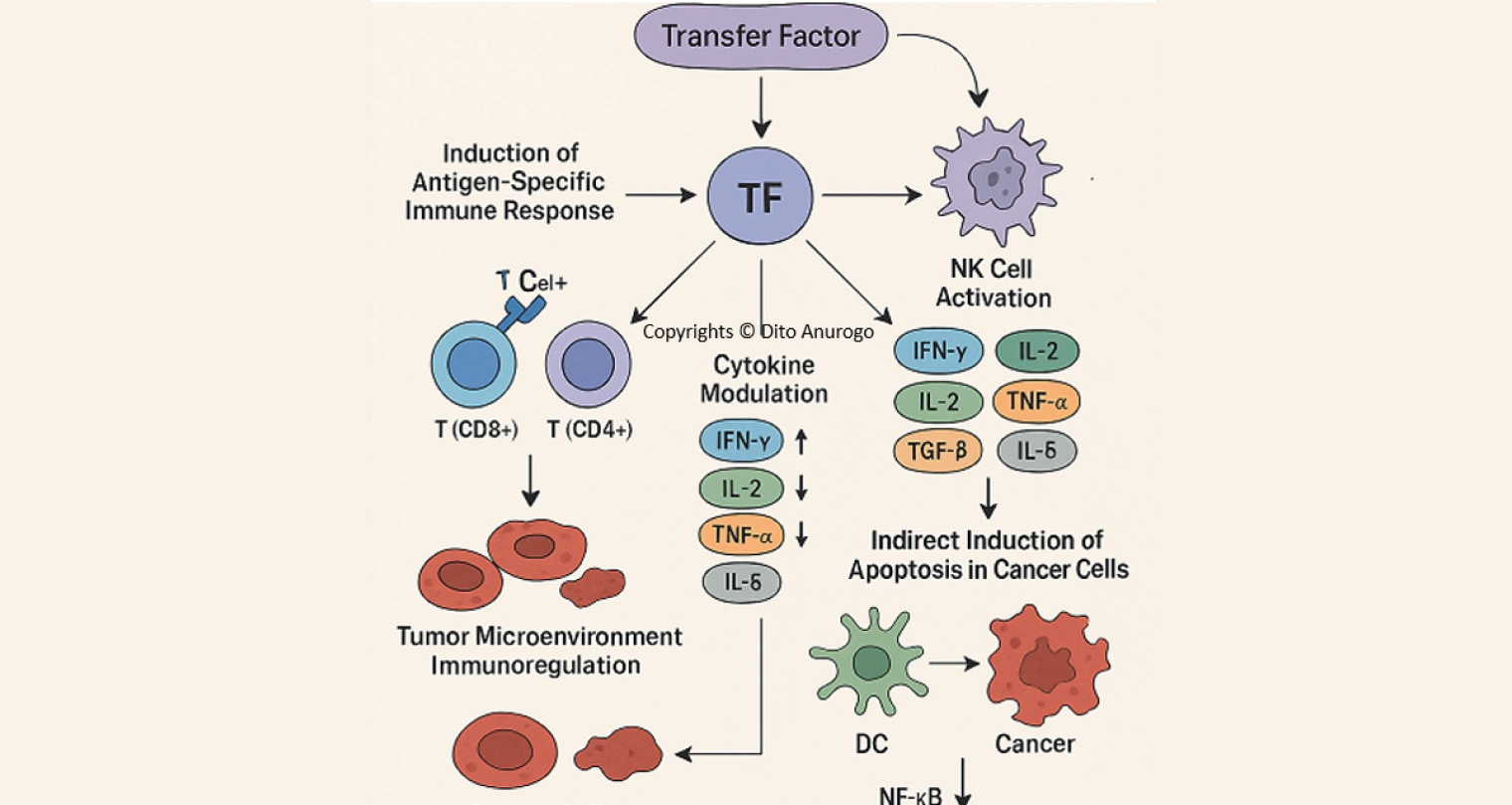
Perang melawan kanker seringkali terasa seperti pertempuran asimetris. Sel-sel ganas itu licik; mereka menyamar, menekan pasukan pertahanan tubuh, dan membangun benteng mikroenvironment yang protektif. Imunoterapi, strategi yang memanfaatkan sistem imun tubuh sendiri sebagai senjata, telah menjadi revolusi dalam pengobatan kanker. Di tengah berbagai pendekatan imunoterapi—mulai dari checkpoint inhibitors (penghambat titik kendali imun) hingga CAR-T cells—tersembunyi satu molekul kecil yang menjanjikan namun kerap kurang dikenal: Transfer Factor (TF). TF ini ibarat "flashdisk imunologi", suatu perangkat kecil yang mampu mentransfer "program" pengetahuan imun dari donor yang sehat ke penerima yang membutuhkan.
Artikel ini membahas bagaimana molekul peptida kecil ini (berat molekul 3.5-12 kDa) bekerja melalui jalur molekuler dan imunologis yang kompleks untuk menggerakkan sistem imun melawan kanker, bukan dengan menghancurkan sel kanker secara langsung, tetapi dengan memodulasi dan memperkuat pertahanan alami tubuh.
Apa Itu Transfer Factor? Memecah Kode Molekul Pembawa Pesan Imun
Transfer Factor bukanlah vitamin, mineral, atau obat kimia sintetis. Ia merupakan fraksi dialisat (hasil penyaringan) leukosit (sel darah putih) yang diekstrak dari individu atau spesies yang memiliki sistem imun kompeten (biasanya sapi atau ayam yang telah terpapar berbagai antigen). Komponen utamanya adalah peptida kecil yang terikat dengan nukleotida.
- Mekanisme Kunci: Transfer Informasi Imun
- "Mentransfer" Sensitivitas
TF mengandung antigen-specific dialyzable leukocyte extracts (ekstrak leukosit yang dapat didialisis spesifik antigen). Komponen ini membawa "memori imunologis" tentang antigen tertentu—termasuk antigen terkait tumor—yang telah dikenali oleh sistem imun donor. - "Mengedukasi" Sel Penerima
Ketika diberikan ke penerima, komponen TF ini berinteraksi dengan sel-sel imun penerima, terutama limfosit (sel T dan sel B) dan dendritic cells (DC, sel dendritik). Ia tidak menggantikan sistem imun penerima, tetapi memberikan informasi spesifik yang mempercepat dan mempertajam respons imun penerima terhadap target tertentu—dalam hal ini, sel kanker. Bayangkan seorang ahli navigator (TF) yang memberikan peta rinci musuh (sel kanker) kepada pasukan khusus (sel imun penerima) yang belum pernah ke medan perang tersebut.
- "Mentransfer" Sensitivitas
Jalur Molekuler dan Imunologis: Bagaimana TF Menggerakkan Serangan Anti-Kanker
Mekanisme aksi TF dalam terapi kanker bersifat multimodal, memengaruhi berbagai lini pertahanan imun. Berikut adalah penjelasan mendalam jalur-jalur kritis yang terlibat:
1. Mengaktivasi Pasukan Khusus: Induksi Respons Imun Spesifik-Antigen
Ini adalah fungsi inti TF. Dengan membawa determinan antigenik dari tumor, TF secara efektif "memperkenalkan" sel kanker kepada sistem imun penerima yang mungkin belum mengenalinya dengan baik atau telah dibuat "toleran".
- Mekanisme Seluler
TF merangsang aktivasi dan proliferasi sel T CD8+ sitotoksik (CTL, Cytotoxic T Lymphocytes), yang bertugas membunuh sel kanker secara langsung, dan sel T CD4+ helper (Th, T Helper cells), yang mengkoordinasikan respons imun secara keseluruhan. - Jalur Molekuler Kunci (Aktivasi Sel T)
- TCR Engagement
Determinant antigenik dalam TF dapat dipresentasikan oleh Major Histocompatibility Complex (MHC) pada Antigen-Presenting Cells (APC, Sel Penyaji Antigen) seperti DC kepada T Cell Receptor (TCR) pada sel T penerima. (MHC: Sistem protein unik pada permukaan sel yang menyajikan potongan antigen; TCR: Reseptor pada sel T yang mengenali antigen yang dipresentasikan MHC). - Signal Transduction Cascade (Rantai Transduksi Sinyal)
Pengikatan TCR-MHC memicu fosforilasi rantai CD3ζ terkait TCR → Mengaktivasi kinase ZAP-70 (Zeta-chain-associated protein kinase 70) → ZAP-70 memfosforilasi adaptor LAT (Linker for Activation of T cells) → LAT merekrut PLCγ (Phospholipase C gamma) → PLCγ memecah PIP2 menjadi IP3 dan DAG → IP3 menyebabkan pelepasan ion Kalsium (Ca²⁺) dari retikulum endoplasma → Peningkatan Ca²⁺ intraseluler mengaktivasi kalkineurin → Kalkineurin mendefosforilasi NFAT (Nuclear Factor of Activated T-cells) → NFAT masuk ke inti sel dan memicu transkripsi gen-gen terkait proliferasi dan fungsi efektor (seperti sitokin IL-2, IFN-γ, dan molekul sitotoksik seperti perforin/granzim).
- TCR Engagement
- Dampak Anti-Kanker
Sel T CD8+ yang diaktivasi dapat mengenali dan membunuh sel kanker secara spesifik. Sel T CD4+ membantu optimalisasi respons ini dengan melepaskan sitokin dan membantu aktivasi CTL dan sel imun lainnya.
2. Memobilisasi Pasukan Pembunuh Bawaan: Aktivasi Sel Natural Killer (NK)
Sel NK adalah garda terdepan imunitas bawaan (innate immunity) yang sangat efektif membunuh sel yang stres, terinfeksi virus, atau ganas tanpa perlu sensitisasi antigenik sebelumnya.
- Mekanisme Seluler
TF meningkatkan baik jumlah (proliferasi) maupun aktivitas sitotoksik (killing capacity) sel NK. - Jalur Pengenalan Sel NK
Sel NK mengenali sel kanker yang sering mengalami downregulation (penurunan ekspresi) molekul MHC Kelas I (biasanya sinyal "jangan bunuh saya"). TF memfasilitasi interaksi antara reseptor aktivasi pada sel NK (seperti NKG2D, NCRs) dan ligan-ligannya yang terekspresi pada sel stres/kanker. - Jalur Sitotoksik: Aktivasi sel NK oleh TF meningkatkan ekspresi dan pelepasan:
- Perforin: Protein yang membentuk pori-pori pada membran sel target.
- Granzim (terutama Granzim B): Protease yang masuk melalui pori perforin dan mengaktifkan kaskade kaspase (caspases) di dalam sel target, memicu apoptosis (programmed cell death, kematian sel terprogram).
- Interferon-gamma (IFN-γ): Sitokin krusial yang memiliki efek anti-proliferasi langsung pada beberapa sel tumor, mengaktivasi makrofag, meningkatkan presentasi antigen, dan merekrut lebih banyak sel imun ke lokasi tumor. (Sitokin: Protein pensinyalan yang dikeluarkan sel imun untuk berkomunikasi).
- Dampak Anti-Kanker
Peningkatan aktivitas NK memberikan lini pertahanan cepat dan efektif, terutama terhadap sel kanker yang mencoba menghindari deteksi sel T spesifik.
3. Mengatur Lingkungan Medan Perang: Modulasi Keseimbangan Sitokin dan Jalur Transkripsi
Mikroenvironment tumor seringkali merupakan tempat yang imunosupresif, didominasi oleh sinyal-sinyal yang menekan imunitas. TF berperan sebagai "direktur orkestra sitokin", menggeser keseimbangan dari keadaan imunosupresif pro-tumor (Th2/Treg bias) ke keadaan imunostimulatorik anti-tumor (Th1 bias).
- Pergeseran Keseimbangan Sitokin
- Meningkatkan Ekspresi Sitokin Pro-Inflamasi & Anti-Tumor
- IFN-γ (Interferon-gamma): Merupakan sitokin kunci imunitas seluler. Meningkatkan aktivitas makrofag (macrophage activation), sel NK, diferensiasi sel T CD4+ menjadi subset Th1 (T Helper 1), dan ekspresi MHC pada sel tumor (membuatnya lebih "terlihat").
- IL-2 (Interleukin-2): Disebut "faktor pertumbuhan sel T". Vital untuk proliferasi dan fungsi sel T dan sel NK. Esensial dalam mempertahankan respons imun adaptif.
- TNF-α (Tumor Necrosis Factor-alpha): Memiliki efek sitotoksik langsung pada beberapa jenis sel tumor, menginduksi nekrosis (kematian sel tidak terprogram), dan mengganggu suplai darah tumor (anti-angiogenesis).
- Menurunkan Ekspresi Sitokin Imunosupresif dan Pro-Tumor:
- IL-4, IL-5, IL-10: Sitokin yang terkait dengan respons imun humoral (antibodi) dan subset sel T helper Th2. Secara berlebihan, dapat menekan imunitas seluler anti-tumor dan mempromosikan fenotipe imunosupresif. (Imunitas Humoral: Bagian imunitas yang dimediasi antibodi).
- TGF-β (Transforming Growth Factor-beta): Imunosupresor kuat yang menghambat aktivasi dan fungsi hampir semua sel imun efektor (sel T, NK, makrofag), mempromosikan diferensiasi sel T regulator (Treg), dan mendorong metastasis.
- IL-6 (Interleukin-6): Mendorong peradangan kronis, angiogenesis (pembentukan pembuluh darah baru), metastasis, dan kelangsungan hidup sel kanker. Juga terkait dengan penekanan imun.
- Meningkatkan Ekspresi Sitokin Pro-Inflamasi & Anti-Tumor
- Jalur Transduksi Sinyal Utama
- JAK-STAT Pathway: Sitokin seperti IFN-γ dan IL-2 mengikat reseptornya di permukaan sel → Mengaktivasi kinase JAK (Janus Kinases) → JAK memfosforilasi STAT (Signal Transducers and Activators of Transcription) → STAT yang terfosforilasi berdimerisasi (berpasangan) dan bermigrasi ke inti sel → Mengatur transkripsi ratusan gen yang terlibat dalam pertahanan anti-virus, proliferasi sel, dan aktivasi imun. Jalur ini sangat sentral dalam efek imunomodulatori TF.
- NF-κB Pathway: Jalur transkripsi sentral yang mengatur gen-gen terkait peradangan, kelangsungan hidup sel (cell survival), proliferasi, dan apoptosis. Meskipun peradangan akut bisa menguntungkan, aktivasi NF-κB kronis pada sel kanker adalah pro-tumorigenik. TF dapat menekan aktivasi NF-κB yang tidak terkendali pada sel kanker atau dalam mikroenvironment, sehingga mengurangi ekspresi gen pro-survival, pro-inflamasi kronis, dan pro-angiogenik. (NF-κB: Nuclear Factor kappa-light-chain-enhancer of activated B cells).
- Dampak Anti-Kanker
Pergeseran keseimbangan sitokin ini menciptakan mikroenvironment yang lebih kondusif untuk serangan imun anti-tumor dan kurang mendukung pertumbuhan dan metastasis kanker.
4. Menetralkan Pengkhianat: Imunoregulasi dalam Mikroenvironment Tumor
Tumor seringkali merekrut dan mengaktifkan sel-sel imun yang justru melindunginya.
- Mekanisme Seluler
- Penekanan Sel T Regulator (Treg): Treg (CD4+CD25+FoxP3+) adalah subpopulasi sel T yang berfungsi menekan respons imun berlebihan untuk mencegah autoimunitas. Namun, pada tumor, Treg seringkali overaktif dan menekan respons anti-tumor sel T efektor dan sel NK. TF dapat mengurangi jumlah dan/atau fungsi imunosupresif Treg dalam mikroenvironment tumor.
- Pematangan dan Fungsi Sel Dendritik (DC): DC adalah "sel penyaji antigen profesional" yang esensial untuk memulai respons imun adaptif spesifik. Dalam tumor, DC seringkali belum matang (immature) atau disfungsional, gagal mempresentasikan antigen tumor dengan baik dan malah mempromosikan toleransi. TF dapat membantu menormalkan pematangan dan fungsi DC, meningkatkan kemampuan mereka dalam mempresentasikan antigen tumor dan mengaktivasi sel T naif menjadi sel T efektor anti-tumor.
- Dampak Anti-Kanker
Dengan mengurangi hambatan imunosupresif (Treg) dan meningkatkan inisiasi respons imun (DC), TF membantu membuka "rem" yang diinjak oleh tumor terhadap sistem imun.
5. Memicu Bunuh Diri Terprogram: Induksi Apoptosis Tidak Langsung
TF tidak membunuh sel kanker secara langsung, tetapi memfasilitasi sel-sel imun untuk menginduksi apoptosis pada sel target.
- Mekanisme Molekuler
- Jalur Fas-FasL: Sel T CD8+ dan sel NK yang diaktivasi oleh TF meningkatkan ekspresi Fas Ligand (FasL) di permukaannya. FasL berikatan dengan reseptor Fas (CD95) di permukaan sel kanker → Pengikatan ini menyebabkan trimerisasi Fas → Merekrut protein adaptor (FADD, Fas-Associated Death Domain) → FADD merekrut dan mengaktivasi prokaspase-8 → Caspase-8 yang aktif memotong dan mengaktivasi caspase efektor (seperti caspase-3) → Caspase-3 memecah protein seluler vital → Apoptosis sel kanker. (Apoptosis: Proses kematian sel terprogram yang terkontrol dan tidak menyebabkan peradangan berlebihan).
- Jalur TRAIL-DR4/DR5: Sel imun juga mengekspresikan TRAIL (TNF-Related Apoptosis-Inducing Ligand). TRAIL berikatan dengan reseptor kematian DR4 (TRAIL-R1) atau DR5 (TRAIL-R2) di permukaan sel kanker → Pengikatan menyebabkan agregasi reseptor → Merekrut FADD dan prokaspase-8 → Mengaktivasi kaskade kaspase yang sama seperti jalur Fas → Apoptosis. Jalur TRAIL sangat menarik karena banyak sel kanker lebih sensitif terhadapnya dibanding sel normal.
- Dampak Anti-Kanker
Menginduksi apoptosis adalah cara yang bersih dan terkontrol untuk menghilangkan sel kanker, meminimalkan kerusakan jaringan sekitarnya dan peradangan berbahaya.
6. Menghancurkan Jalur Logistik Tumor: Inhibisi Jalur Pro-Tumorigenik
Sel kanker seringkali mengandalkan jalur pensinyalan tertentu untuk bertahan hidup, tumbuh tak terkendali, dan menyebar.
- Target Molekuler Utama
- NF-κB (Nuclear Factor-kappa B): Seperti disebutkan sebelumnya, aktivasi NF-κB yang konstitutif (terus-menerus) adalah ciri banyak kanker. NF-κB mendorong ekspresi gen-gen yang mendukung proliferasi sel (cell proliferation), kelangsungan hidup (survival), angiogenesis, metastasis, dan resistensi kemoterapi. TF dapat menghambat aktivasi NF-κB pada sel kanker atau dalam mikroenvironment tumor, sehingga menekan efek pro-tumorigeniknya.
- COX-2 (Cyclooxygenase-2): Enzim yang terlibat dalam produksi prostaglandin. Ekspresi berlebihan COX-2 pada kanker terkait dengan peradangan kronis, proliferasi, penekanan imun, angiogenesis, dan metastasis. TF dapat menurunkan ekspresi COX-2.
- VEGF (Vascular Endothelial Growth Factor) dan Molekul Pro-Angiogenik Lainnya: Tumor membutuhkan suplai darah untuk tumbuh di atas ukuran tertentu. Mereka melepaskan faktor-faktor seperti VEGF untuk merangsang angiogenesis (pembentukan pembuluh darah baru). TF dapat menekan ekspresi VEGF dan faktor pro-angiogenik lainnya (seperti bFGF, basic Fibroblast Growth Factor).
- Dampak Anti-Kanker
Dengan menghambat jalur-jalur kunci ini, TF merusak kemampuan tumor untuk berkembang biak, bertahan hidup, dan membangun infrastruktur (pembuluh darah) yang dibutuhkannya untuk tumbuh dan menyebar.
Bukti Klinis dan Aplikasi Potensial: Dari Teori ke Praktik
Penelitian tentang TF dalam kanker masih berkembang, terutama di bidang in vitro (laboratorium) dan model hewan, dengan beberapa studi klinis pada manusia menunjukkan hasil yang menjanjikan:
- Studi Preklinis
Banyak penelitian menunjukkan bahwa TF, terutama yang berasal dari donor yang telah disensitisasi dengan antigen tumor tertentu (specific TF), dapat meningkatkan aktivitas sel NK, meningkatkan proliferasi limfosit, menggeser profil sitokin ke arah Th1, dan menghambat pertumbuhan tumor pada model hewan. TF juga menunjukkan efek sinergis dengan kemoterapi dan terapi radiasi. - Studi Klinis pada Manusia
Beberapa studi kecil telah mengevaluasi TF pada berbagai kanker, termasuk melanoma, kanker paru non-sel kecil (NSCLC), kanker payudara, osteosarkoma, dan neuroblastoma. Hasilnya bervariasi, tetapi beberapa menunjukkan manfaat seperti peningkatan respons imun, penurunan efek samping pengobatan konvensional, peningkatan kualitas hidup, dan dalam beberapa kasus, peningkatan kelangsungan hidup (survival) atau stabilisasi penyakit. Namun, studi yang lebih besar dan terkontrol dengan baik masih diperlukan untuk mengkonfirmasi kemanjuran dan menentukan protokol optimal (dosis, sumber TF, durasi pengobatan). - Aplikasi Potensial
- Terapi Adjuvan: Diberikan bersama pengobatan standar (operasi, kemoterapi, radioterapi) untuk meningkatkan efek anti-tumor dan melindungi sistem imun.
- Pencegahan Relaps: Mempertahankan pengawasan imun (immunosurveillance) setelah pengobatan utama untuk membunuh sel kanker residual dan mencegah kekambuhan.
- Peningkatan Kualitas Hidup: Mengurangi imunosupresi terkait kanker atau pengobatan, menurunkan insiden infeksi oportunistik, dan meningkatkan kesejahteraan umum pasien.
- Kanker yang Resisten: Berpotensi untuk kanker yang resisten terhadap imunoterapi konvensional (seperti checkpoint inhibitors), terutama jika ketahanan tersebut disebabkan oleh mikroenvironment imunosupresif atau kurangnya infiltrasi sel T.
- Kanker Pediatrik: Penggunaan TF pada kanker anak seperti neuroblastoma telah menunjukkan potensi dalam beberapa laporan.
Tantangan dan Masa Depan: Memperhalus "Flashdisk" Imunologi
Meskipun menjanjikan, penggunaan TF dalam terapi kanker menghadapi beberapa tantangan:
- Standardisasi dan Kontrol Kualitas: Sumber donor (spesies, status imun), metode ekstraksi, dan karakterisasi produk TF sangat bervariasi, menyulitkan reproduktibilitas hasil dan perbandingan antar studi.
- Spesifisitas Antigen: Efektivitas TF spesifik-antigen (specific TF) bergantung pada kecocokan antigen antara TF dan tumor pasien. Mengidentifikasi dan memproduksi TF yang sangat spesifik untuk tumor individu masih kompleks.
- Farmakokinetik dan Biodistribusi: Pemahaman tentang bagaimana TF didistribusikan dalam tubuh, berapa lama bertahan, dan bagaimana ia mencapai target sel imun masih perlu diperdalam.
- Studi Klinis Berkualitas Tinggi: Kebutuhan mendesak akan uji klinis fase II/III yang dirancang dengan baik, acak, terkontrol plasebo, dengan jumlah sampel yang memadai untuk membuktikan kemanjuran klinis yang kuat.
- Mekanisme Pasti: Meskipun efek imunomodulatori umum telah diidentifikasi, mekanisme molekuler yang tepat tentang bagaimana komponen TF berinteraksi dengan reseptor spesifik pada sel imun masih menjadi area penelitian aktif.
Masa Depan Transfer Factor
- Teknologi -Omics: Penggunaan genomik, proteomik, dan analisis multi-omics lainnya untuk mengkarakterisasi komponen TF secara lebih komprehensif dan mengidentifikasi molekul aktif utamanya.
- Rekayasa TF: Mengembangkan TF rekombinan atau TF yang dimodifikasi secara sintetis dengan spesifisitas antigen yang ditingkatkan, stabilitas, dan potensi.
- Kombinasi Pintar: Mengeksplorasi kombinasi sinergis TF dengan modalitas imunoterapi lain (seperti checkpoint inhibitors - penghambat PD-1/PD-L1 atau CTLA-4, terapi sel CAR-T), terapi target, atau vaksin kanker.
- Obat Personalisasi: Pengembangan pendekatan berbasis TF yang sangat disesuaikan dengan profil imunologis dan mutasi tumor pasien individu.
Memanfaatkan Kecerdasan Kolektif Sistem Imun
Transfer Factor mewakili paradigma menarik dalam imunoterapi kanker. Daripada menyerang tumor secara langsung atau secara artifisial mengaktivasi sistem imun secara masif (yang bisa berbahaya), TF bekerja dengan cerdas dengan memanfaatkan "kecerdasan kolektif" yang terkandung dalam sistem imun donor yang telah terlatih. Ia berfungsi sebagai modulator halus yang memperbaiki komunikasi yang rusak, meningkatkan kemampuan deteksi, menghilangkan penekanan, dan mengoptimalkan serangan imun yang terkoordinasi terhadap kanker.
Jalur-jalur molekuler dan imunologis yang terlibat—mulai dari aktivasi spesifik sel T dan NK, modulasi sitokin, imunoregulasi mikroenvironment, induksi apoptosis, hingga inhibisi jalur pro-tumorigenik—menggambarkan pendekatan yang multi-target dan komprehensif. Meskipun tantangan dalam standardisasi dan validasi klinis masih ada, potensi TF sebagai terapi adjuvan yang meningkatkan respons terhadap pengobatan standar, mencegah kekambuhan, dan meningkatkan kualitas hidup pasien kanker sangatlah signifikan.
Seperti kata Dr. Lloyd J. Old, salah satu pelopor imunologi kanker, "The immune system sees cancer not as a foreign invader, but as a part of the self gone wrong." (Sistem imun melihat kanker bukan sebagai penyerang asing, tetapi sebagai bagian dari diri yang salah). Transfer Factor berpotensi menjadi alat kunci untuk "membuka mata" sistem imun terhadap kesalahan ini, memanfaatkan pengetahuan imun yang telah diperoleh dari "diri lain" yang sehat, untuk membimbing sistem imun pasien dalam mengenali dan membasmi kanker dengan lebih efektif. Penelitian berkelanjutan dan uji klinis yang ketat akan menentukan apakah "flashdisk imunologi" ini dapat menjadi senjata standar dalam gudang senjata kita melawan kanker.
Profil Penulis
Dito Anurogo, M.D., M.Sc., Ph.D., seorang dokter umum, dosen tetap di Fakultas Kedokteran dan Ilmu Kesehatan Universitas Muhammadiyah Makassar, Indonesia. Dito turut andil dalam penyusunan Peraturan Menteri Kesehatan No. 32 Tahun 2018 tentang Layanan Sel Punca dan/atau Terapi Sel, bersama tim ASPI (Asosiasi Sel Punca Indonesia). Publikasi terbarunya berfokus pada sel punca dan nanoteknologi. Karyanya yang terkenal meliputi The Art of Medicine, The Art of Televasculobiomedicine 5.0, Digital Health Made Easy (Buku ini telah diterima oleh presiden Taiwan sebagai penghubung kerjasama Indonesia-Taiwan), dan Ensiklopedia Penyakit dan Gangguan Kesehatan. Alumnus PhD dari IPCTRM, College of Medicine, Taipei Medical University, Taiwan, setelah sebelumnya menyelesaikan studi S2 di bidang Ilmu Kedokteran Dasar dan Biomedik di Universitas Gadjah Mada.
Dito telah menerbitkan puluhan buku, menjadi kolumnis, jurnalis, memelopori bidang Nanoimmunobiotechnomedicine (NiBTM), hematopsikiatri. Ia juga aktif mempromosikan literasi digital dan pemberdayaan masyarakat. Dito juga meraih lebih dari 50 sertifikasi dengan gelar non-akademik, termasuk bidang kedaruratan medis, tumbuhan obat, grafologi dasar, jurnalisme. Ia juga berperan sebagai reviewer di puluhan jurnal nasional dan internasional terindeks Scopus Q1, dengan pengalaman lebih dari 20 tahun di puluhan organisasi, sebagai pendiri, ketua, dan pengurus.
Dito pernah menjabat sebagai Wakil Ketua dan Ketua Komisi Kesehatan di Perhimpunan Pelajar Indonesia Dunia (Ditlitka PPI Dunia) dengan program unggulan Telehealth-Telemedicine. Prestasinya meliputi penghargaan Best Paper Award di kategori Best Idea pada 5th International Conference on Religious and Cultural Sciences 2023, Peace Ambassador WWPO di Indonesia 2022, dan International Scientist Awards 2022 dalam bidang sains, teknik, dan kedokteran. Sebagai alumnus Madrasah Takhasus (TKS) PPMI Assalaam Sukoharjo Jawa Tengah, Dito juga telah menerima berbagai penghargaan nasional dan internasional atas kontribusinya di bidang ilmu pengetahuan, kedokteran, dan kemanusiaan. Tulisannya dapat dibaca di: Dito Anurogo - Kumpulan Berita ANTARA News dan dr. Dito Anurogo, M.Sc., Ph.D., Kontributor di BERNAS.id dan PENULIS Ayo Sehat Kemkes: Dokter Dito Anurogo, M.Sc., Ph.D